 病因
病因
病因:老年人糖尿病大多数为2型
糖尿病,极少数为1型
糖尿病。国内外学者认为2型DM系多基因遗传性疾病,多个基因的微妙累积作用,再加上后天发病因素,就可使老年人2型
糖尿病发病。
1.遗传基因 我国各家研究结果表明,中国人
糖尿病遗传方式以多基因遗传为主。项坤三等基于多基因-多因子病理论,采用大标本、多个群体关联联合研究途径,对485例上海市和美国旧金山中国人中6个基因(或基因区)的限制性内切酶段长度多态性(RFLP)与2型DM的关联情况研究见到:胰岛素受体基因、载脂蛋白B(Apo-B)基因和载脂蛋白A
1(Apo-A
1)基因与中国人2型DM发病有一定关联。国内外已一致认识到,胰岛素受体基因改变是2型
糖尿病的胰岛素抵抗、胰岛素相对不足的原因。2型DM本身即可伴脂质代谢紊乱。进一步研究可能会发现老年人糖尿病及其并发症的更多有关基因。
2.环境因素 促使有遗传基础的老年人发生
糖尿病后天发病因素很多,兹举其重要者简述如下:
(1)体力活动:随增龄而体力活动减少,能导致胰岛素敏感性下降,肌肉的废用性萎缩,还会使其摄取葡萄糖的能力降低。
(2)饮食:流行病学及实验研究都已证实,食物中饱和脂肪酸的增多和膳食纤维的不足(食品太精太细),会降低胰岛素的敏感性并降低葡萄糖耐量。
(3)向心型
肥胖、胰岛素抵抗:脂肪的向心性分布(腹型
肥胖、躯干型
肥胖、上半身
肥胖或内脏型
肥胖)系指网膜及肠系膜细胞增大、门脉中游离脂肪酸(F
FA)浓度增高等一系列变化。门脉中F
FA增多会导致VLDL,LDL生成增多、肝糖输出增多以及肝细胞膜上胰岛素受体减少,受体的酪氨酸激酶活性也降低,可能还有受体后缺陷,再加上周围组织的同样变化,就构成了胰岛素抵抗。此时胰岛素的生物效应明显降低,故有代偿性高胰岛素血症。久之,会有胰岛B细胞功能减退。
在胰岛素抵抗及代偿性高胰岛素血症的基础上可发生一种胰岛素抵抗综合征或称
X综合征。此综合征在
糖尿病形成之前就已存在,后来
糖尿病又成为此综合征的一部分。此综合征包括向心性
肥胖、高血糖、高三酰甘油血症伴高LDL血症、高血压、微量白蛋白尿、
冠心病和高尿酸血症等。
(4)胰岛淀粉样蛋白沉积,胰岛B细胞功能减退:CecilRI在1909年报道90例
糖尿病患者的胰
腺病理改变时,曾观察到这种淀粉样物质沉积,但误认为是老年非特异性改变。它和2型DM的重要关系,通过近些年Westermark P,Cooper
GTS(1987),Clark A(1988)及以后学者们的研究,才有进一步新认识。
90% 2型DM患者胰岛有此淀粉样沉积物,明显高于同年龄对照组。2型DM最重要病理改变之一就是这种胰岛淀粉样物沉积,B细胞明显减少,A细胞相对增多,重度的2型DM患者可能有90%的胰岛素空间被淀粉样沉积物所占据,它损害并取代B细胞,使其所剩无几,而必须用外源胰岛素来补充之。
从胰岛淀粉样沉积物中已分离纯化出具有37个氨基酸的胰岛淀粉样蛋白多肽(isleta myloid poly peptide,IAPP)也称胰淀素(amylin),又称
糖尿病相关肽(DAP)。已明确IAPP是胰岛B细胞激素。在葡萄糖和其他促泌因素作用下和胰岛素一同释放。
肥胖者血中IAPP浓度更高些。动物实验已证实,血循环中胰淀素达到一定高度时可抑制胰岛素从B细胞内释放,从而使糖耐量下降。在得到良好代谢控制的2型DM患者,IAPP浓度并不增高。由于此种多肽还能下降调节胰岛素刺激的糖原合成速率和骨骼肌细胞的葡萄糖处理速率,故它在2型DM患者的胰岛素抵抗中也具特殊作用。
3.胰岛素分泌量改变因素 当人体逐渐衰老时,胰岛素分泌量的改变众说不一,有说减少,有说增加,有说不减少而延迟,也有说正常。通过文献分析与临床观察,可以认为,这些不同结果,是不同病程的反映,初诊及病程短者胰岛素水平往往接近正常,病久者由于胰岛B细胞功能逐渐减退,胰岛素水平可能降低,此时有些患者需要补充胰岛素。
4.胰岛素原因素 人体逐渐衰老时,其总胰岛素量虽有一定水平,但其中胰岛素原相对增多。人类胰岛素原抑制肝葡萄糖生产作用的活性只有胰岛素的1/10,在相同的基础状态下,年轻人的胰岛素原总分泌数(总分泌数=胰岛素 胰岛素原)和老年人相同;但在葡萄糖负荷后,血液循环中可测知的胰岛素原老年人为22%,而青年人只有15%,胰岛素原较多,也可能是老年人糖尿病增多的原因之一。
5.基础代谢因素 人在逐渐衰老过程中,基础代谢率逐渐下降,参与人体活动的各级组织尤其是肌肉代谢下降,机体对葡萄糖的利用能力下降。
6.人体组织改变因素 人体逐渐衰老过程中,即使不超重,由于体力活动减少,身体组织即肌肉与脂肪之比也在改变,肌肉由占人体的47%减至36%,脂肪由20%增加到36%。脂肪相对增加则会使胰岛素敏感性下降。这也是老年人糖尿病增多的原因之一。
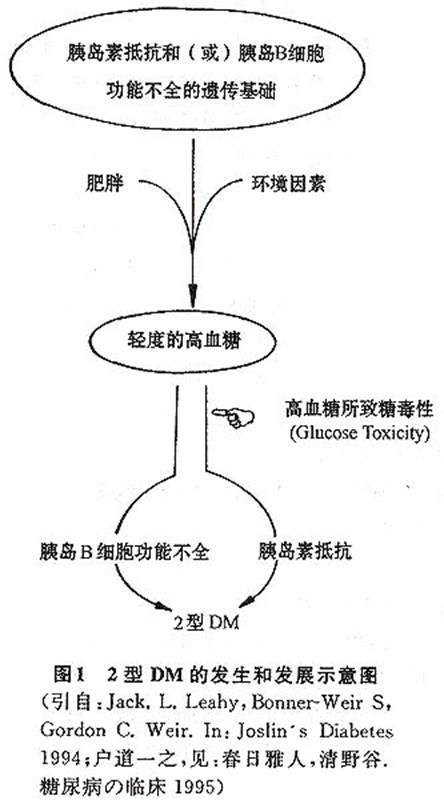
综上所述及图1所示:老年人2型DM发病机制及程序可概括如下:具有胰岛素抵抗和(或)胰岛B细胞功能不全的遗传基础,再加上年龄增加、相对过食、缺乏活动所致
肥胖(特别是向心型
肥胖)或体内脂肪相对增多等后天环境多因素的累积作用,就会引发血液中葡萄糖的轻度升高,而慢性持续性高血糖的毒性作用,就会进一步引发并加重胰岛素抵抗和(或)胰岛B细胞功能不全,乃引起2型DM及各种并发症。一般而言,在腹型
肥胖者主要发生胰岛素抵抗(空腹及糖负荷后胰岛素和C肽分泌增加),久之可致胰岛B细胞功能不全;而在非
肥胖者主要发生胰岛B细胞功能不全,也有胰岛素抵抗。
 发病机制
发病机制
发病机制:2型
糖尿病的发病机理十分复杂,迄今尚未完全阐明。根据最近数十年积累的知识看来,主要集中在胰岛功能缺陷,特别是B细胞胰岛素分泌缺陷及胰岛素的作用缺陷,亦即胰岛素抵抗两方面。近年来,国内外学者开始注意到除了胰腺及胰岛素的靶器官而外,很可能中枢神经系统在2型
糖尿病的发病中起一定的作用。
1.胰岛功能缺陷
(1)B细胞功能缺陷:
①胰岛素分泌的缺陷:自从20世纪50年代末,放射免疫分析法建立以来,全世界学者对于生理、病理状态下B细胞的胰岛素分泌进行了大量研究,对胰岛素分泌缺陷已有了较多的认识,概括如下:
A.胰岛素分泌绝对量不足:在20世纪80年代中后期以前,一般认为2型
糖尿病特别是早期胰岛素的分泌不是缺乏而是过多,即存在高胰岛素血症。直到1989年Temple采用净胰岛素测定法(而非IRI)发现2型
糖尿病患者,不管IRI是正常或增高,其血浆游离胰岛素水平均是降低的。近年较多单位采用前胰岛素及游离胰岛素测定证明了Temple的结论。即过去所谓胰岛素血症实际是高前胰岛素血症,特别是空腹脱31,32前胰岛素呈现出不成比例的增高,即前胰岛素/胰岛素比值(PI/I)增高,但与N
GT配对比较时,其真胰岛素水平仍然是降低的。有研究认为PI/I比值是反映前胰岛素加工及胰岛素分泌缺陷的标志,其增高对2型
糖尿病的发生具有预告作用。
B.胰岛素分泌方式异常即胰岛素失去生理分泌的正常模式,这包括:对葡萄糖刺激感知的选择性丧失或反应迟钝,但保留了对氨基酸刺激的反应,对葡萄糖刺激的第1时相分泌消失,第2时相分泌延迟;胰岛素分泌的脉冲数、频率及振幅变化、节律紊乱等。这样就导致胰岛素水平升降与血糖水平不同步。
C.胰岛素基因突变合成无生物活性、结构异常的胰岛素,如Chicago变异胰岛素,Tokyo变异胰岛素等。但此种情况在2型
糖尿病中属罕见。
B细胞胰岛素分泌缺陷的原因包括两方面:一为遗传性,如Polnsky等指出的系“B细胞基因程控”所致。最有力的支持证据为
糖尿病前期在血糖正常时,甚至在血糖正常的
糖尿病一级亲属中胰岛素分泌缺陷即已存在。此种胰岛素分泌缺陷称之为B细胞的“原发衰竭”。另一因素为获得性,系由于高血糖或胰岛素抵抗所致。即高血糖对B细胞的毒性作用(葡萄糖中毒)。降
低血糖可改善B细胞功能。近年发现血浆游离脂肪酸(F
FA)异常增高亦可抑制胰岛素的分泌(脂肪中毒,lipotoxicity)。此种胰岛素分泌缺陷为对胰岛素抵抗应激的失代偿,亦称B细胞应激性衰竭。
在2型
糖尿病的发病中可能遗传因素与获得性因素交互作用,共同导致B细胞胰岛素分泌障碍。
胰淀素分泌的异常。很早以前就知道2型
糖尿病胰岛内有大量淀粉样物质沉着,但对其来源和发生机理不明。直到20世纪80年代才发现此37氨基酸多肽系B细胞合成和分泌,命名为胰淀粉样多肽(IAPP)或胰淀素(amylim)。它与胰岛素共同分泌。在B细胞内其分子比(IAPP/胰岛素)为0.1~0.05。因遗传或获得性因素致B细胞内IAPP/胰岛素比例增加时,则胰淀素的纤维可沉积于B细胞内质网或高尔基体引起B细胞凋亡,导致
糖尿病发生。
但在人体的试验,此假说未被完全证明。Tasaka等最近报道44例2型
糖尿病尸解资料,他们于死亡前3年至死前1个月均测定过血清IRI,C肽、血糖及血清胰淀素水平。死亡胰尾用刚果红及Masson染色,将患者分为IAPP染色阳性与阴性两组,分别与IRI、C肽、血糖水平比较,除1例胰岛IAPP沉积严重,血IAPP浓度高者胰岛素水平降低外,其余未发现有肯定的关系。因此,IAPP影响B细胞胰岛素分泌之说尚有争议。
此外,IAPP尚有抑制精氨酸刺激的胰升糖素分泌的作用,但不抑制
低血糖所致之胰升糖素升高的反应。另外,IAPP还具有抑制胃排空的作用。
总之,IAPP在2型
糖尿病发病中的作用仍不清楚,有待进一步研究。
(2)A细胞:A细胞在2型
糖尿病时呈现胰升糖素分泌增加。胰升糖素升高促进氨基酸及游离脂肪酸(F
FA)转化为葡萄糖(糖异生),拮抗胰岛素,增加肝糖产生及输出,因而血糖升高。同时胰升糖素尚可促进脂解,增加血F
FA水平,抑制胰岛素分泌及胰岛素的作用,以及生酮作用,因而可导致或加重胰岛素抵抗。
此外,最近的研究发现
糖尿病时胰腺神经肽Y(NPY)分泌增高。胰腺NPY主要由A细胞分泌,它也具有抑制胰岛素分泌的作用。NPY在
糖尿病发病中的作用尚不清楚,推测可能在
糖尿病发病中起一定作用。
(3)胰岛功能失调:除A、B细胞所分泌的以上激素失常外,胰岛内尚分泌生长抑制素(SS、D细胞)、胰多肽(PP、PP细胞)以及胰抑肽等。胰岛内这些激素之间的对话(crosstalking)交互作用,形成岛内的内分泌调控失衡。此种调控失衡可能对
糖尿病发病有一定影响。
2.胰岛素抵抗 胰岛素作用减低即胰岛素的靶细胞对胰岛素的敏感性(SI)下降,又称为胰岛素抵抗,准确地说是生理量的胰岛素作用于靶细胞,其效应低于正常;或欲达到正常的生理效应需要超生理量的胰岛素。胰岛素抵抗主要发生在肝、骨骼肌及脂肪细胞。现分述之。
(1)肝胰岛素抵抗:胰岛素自B细胞分泌后大部分进入门静脉循环,50%以上为肝脏摄取。2型
糖尿病者肝胰岛素摄取减少,不能抑制肝糖产生及输出,因而空腹血糖升高。
(2)肌抵抗:主要表现为餐后胰岛素介导的葡萄糖摄取和利用减少。由于刺激肌细胞对葡萄糖的摄取和利用所需的胰岛素量较抑制肝糖产生及输出者大得多,因而肌胰岛素抵抗在
糖尿病发病中最先表现出来,这就解释了在
糖尿病早期或前期空腹血糖尚在正常范围而餐后血糖已经升高的原因,虽然某些病例尚未达
糖尿病水平,但糖耐量已减低。这也说明在早期
糖尿病筛查时餐后2h血糖较空腹血糖更为敏感。因此WHO及世界上许多
糖尿病专家推荐在
糖尿病人群筛查时空腹及餐后2h血糖两个指标并用,不同意ADA单用空腹血糖筛查,因后者容易造成较多漏诊。但有时也可见到空腹血糖升高而餐后血糖不高的相反现象,这可能系胰岛素抵抗的组织异质性所致。
(3)脂肪抵抗:胰岛素在脂肪细胞作用降低导致脂解加速,血游离脂肪酸(F
FA)水平增高。血F
FA水平升高对人体具有如下不利影响:①抑制B细胞葡萄糖刺激的胰岛素分泌;②抑制肝细胞与胰岛素的结合,削弱胰岛素对肝糖异生及输出的抑制作用;③抑制肌细胞葡萄糖转运子(Glut4)的活性。因而胰岛素介导的葡萄糖肌摄取及利用(葡萄糖氧化及肌糖原合成)均降低;④为肝脏提供生糖底物,促进肝糖异生。因此,F
FA水平升高在胰岛素抵抗以及2型
糖尿病发病中的作用日益受到重视。
此外,脂肪细胞分泌的肿瘤坏死因子(TNF-α)及瘦素在
糖尿病病人及动物均见升高,并产生胰岛素抵抗,可能在2型
糖尿病发病中亦起一定作用。
胰岛素抵抗发生的环节现在认为可发生于胰岛素与受体结合前,或受体或受体后水平。在这个复杂过程中,涉及环节甚多,许多环节及作用尚未弄清。其中已明确者如胰岛素抗体形成、胰岛素分子结构异常及胰岛素降解过速(受体前或受体水平)、胰岛素受体基因突变致受体酪氨酸激酶自体磷酸化障碍,受体合成、转化、结合及降解障碍等(受体水平)以及胰岛素受体底物家系(IRS)基因突变致IRS酪氨配磷酸化减低而丝氨酸磷酸化增强、IRS-1相关PI-3激酶活性降低,PKC通路激活,己糖胺(hexosamine)通路激活,Glut合成及转位障碍以及细胞内糖原合成酶活性下降(受体后)等。
3.胰岛素分泌缺陷与胰岛素抵抗在2型
糖尿病中的相互关系
(1)胰岛素分泌缺陷与胰岛素抵抗在2型
糖尿病发病中的地位:长期以来关于胰岛素分泌缺陷及胰岛素抵抗在2型
糖尿病发病中各自的地位问题,即谁为主要谁为次要,或同等重要诸问题,一直存在争论。但从最近小鼠基因敲除(knockont)实验看,上述争论问题可得到解答。例如敲除了ISSI基因的纯合小鼠老龄时产生高胰岛素血症及胰岛素抵抗,然而糖耐量正常。敲除B细胞葡萄糖激酶(GK)基因的杂合小鼠老龄时胰岛素分泌减少而发生糖耐量低减。而同时敲除IRS-1及GK基因鼠老龄时则发展为显性
糖尿病。故目前认为在
糖尿病发病中二者均需具备。同时,近期研究认为B细胞缺陷与胰岛素抵抗二者是互相依存的,是不可分割的。当胰岛素敏感性降低时,B细胞的分泌代偿性增加(高胰岛素血症)以克服空腹高血糖症(早期);当胰岛素抵抗进一步加重时,B细胞加大代偿能力以克服餐后高血糖(餐后高胰岛素血症)、餐后2h血糖升高超过78mmol/L,标志B细胞丧失代偿能力。此种关系Bergman用数学模式“配置指数”(diposition index)表示,它为胰岛素敏感性×胰岛素分泌量的乘积。评估轻度的胰岛素抵抗比较困难,因为它为B细胞对葡萄糖反应的增加(代偿)所掩盖;同样当胰岛素敏感性下降时,B细胞代偿性分泌增加也掩盖了胰岛素缺乏的潜在倾向。因此,在临床考虑胰岛素抵抗及B细胞功能时应予注意。
(2)B细胞功能缺陷及胰岛素抵抗与2型
糖尿病的因果关系:目前教科书及许多文献都已认为二者为
糖尿病的发病原因。但实际上认真考查过去的许多动物实验及临床研究都不能回答这一问题。因为这些研究结果都是用
糖尿病动物模型获得的。或是来源于
糖尿病病人。要解决这一问题,惟一的办法是从研究
糖尿病的自然史,即将血糖或糖耐量正常的2型
糖尿病可妊娠
糖尿病的高危人群,最好是
糖尿病病人的N
GT一级亲属作为观察对象,长期动态观察他们的胰岛素敏感性及B细胞功能变化直至发展为
糖尿病。
从目前已有资料看来这些高危个体在N
GT阶段即已存在胰岛素分泌减低或胰岛素敏感性降低的现象,且从N
GT向I
GT转化的主要因素为B细胞功能减低加上胰岛素抵抗,而由I
GT向2型
糖尿病转化的主要因素为B细胞功能降低进一步加重。
4.中枢神经系统的作用 已知下丘脑室旁核,视上核,弓状核,腹内侧核等产生的NPY、CRH、脂肪细胞分泌的瘦素,以及下丘脑和胰腺、肾上腺、脂肪细胞之间的相互作用并通过PPARγ及β3受体调节糖代谢、能量贮耗平衡、摄食行为及脂肪分布等,这些调节因子的异常与
肥胖、胰岛素抵抗有关。我们和其他学者的研究亦发现在
糖尿病动物脑内和胰腺的NPY表达均增加。胰岛素治疗可降低脑和胰腺NPY含量,中枢神经系统这些激素调控与
糖尿病发病的关系目前还缺乏研究。推测在
糖尿病发病中起一定作用。
综上所述,2型
糖尿病的发病机理十分复杂,目前尚未完全阐明。从现有知识看来,B细胞功能缺陷和胰岛素抵抗是主要因素。二者皆有遗传易感性背景及环境获得性的成分。但在不同的个体各自所占比重不同,形成胰岛素分泌及胰岛素抵抗的遗传缺陷与环境因素多种不同的组合形式,这样就造成2型
糖尿病高度异质性的特点。
 临床表现
临床表现
临床表现:
糖尿病的临床表现在不同类型的
糖尿病差异较大。1型
糖尿病常有多饮、多食、多尿、消瘦的典型“三多一少”症状,有些甚至因酮症酸中毒
昏迷来首诊。2型
糖尿病多起病隐袭,50%~70%病例首次就诊时并无三多一少症状,有些因其并发症,如视力下降,高血压,
高脂蛋白血症,
冠心病,脑卒中,水肿或蛋白尿,皮肤或
外阴瘙痒,肢体麻木,刺痛或其他感觉障碍而就诊。少数老年人会因高渗非酮症
昏迷而就诊。还有不少人仅在常规体检中发现血糖升高而诊断为
糖尿病。随着
糖尿病病程的延长,越来越多的人会出现白内障或视网膜病变而出现视力障碍甚至失明;糖尿病肾病可致不同程度的肾功能损害直到发生尿毒症;周围神经病变可致手足麻木或刺痛及间歇性跛行,脑卒中引起的肢体
瘫痪;下肢血管病变晚期有足趾坏疽;胃肠神经病变引起胃肠蠕动改变所致
腹泻及
便秘交替;男性病人常有
阳痿;机体抵抗力低常致反复肺感染,胆道感染和泌尿系统感染等;感染、手术、应激、饮食失节还会诱发酮症酸中毒
昏迷。
这种情况在老年人群可能更为严重,
糖尿病初发于老年人时,常比年青人初发
糖尿病病情更轻,病人常不知已发生了
糖尿病。而
糖尿病诊断常是常规血糖检查的结果,或者在常规眼屈光检查发现
糖尿病视网膜病变时做出。单神经病变或开始有性功能障碍也是老年人糖尿病第一个引人注意的症状。更常见的是,病人可能出现轻、中度体重减轻,头晕,无力,伴有一种或几种
糖尿病的主要症状,如多尿、口渴及多食。见表3。这些表现常是由感染引起。感染可能很轻,如真菌性外阴、阴道炎,齿龈脓肿,疖肿或上呼吸道感染。有时以往不知有
糖尿病的老龄病人可能发生与血浆高渗状态有关的
昏迷、抽搐或局灶神经征。这种情况常继发于感染或系由于病人不能饮入足量的水引起。老年人有严重应激时其
糖尿病可表现为酮症酸中毒,可能发生于急性心梗或严重意外。年青时发生的
糖尿病到老年时其表现会有某些变化,这些变化包括所需胰岛素量减少(常伴肾功能不全),尿糖减少(肾糖阈升高)及出现明显
糖尿病大血管,微血管并发症,包括视网膜病变、肾病、神经病变及高血压、心绞痛、脑供血不足等。
 鉴别诊断
鉴别诊断
鉴别诊断:
1.1型
糖尿病和2型
糖尿病的鉴别 典型病例,临床可根据起病年龄、起病缓急、酮症易感以及是否胰岛素治疗等初步对1型或2型
糖尿病作出鉴别,但临床上常遇到不少病例仅根据临床表现难以鉴别,需全面综合考虑,以便采取合理治疗。
2.肝源性
糖尿病 肝脏与糖代谢密切相关,在糖原异生,糖原合成,葡萄糖的摄取、利用和释放等方面均起重要的调节作用。肝病患者糖代谢紊乱比较常见,文献报告,
肝硬化患者约30%可表现为糖耐量减退或
糖尿病。肝脏疾病引起糖耐量异常的原因比较复杂,可能与肝脏糖原合成降低、胰岛素抵抗(可能由游离脂肪酸升高、胰岛素受体减少和胰岛素受体后异常等所致)和激素代谢异常(主要表现为胰升糖素水平明显升高)等有关,
肝硬化治疗过程中所应用的某些药物如噻嗪类利尿剂(治疗
腹水,可致低钾)、β受体阻断药(治疗门脉高压)也可能抑制胰岛素的释放。其糖耐量特点为:①FPG正常或降低,服糖后血糖明显升高,45~90min(多在60min内)达高峰,高峰后血糖下降迅速,一般在120—180min内恢复空
腹水平;但肝功能损害很严重时高血糖持续时间较长;有些病例在服糖后3~5h可有反应性
低血糖。②胰岛素或C肽释放试验基本正常,与血糖平行,但肝病时,肝脏摄取和灭活胰岛素明显减少,胰岛素的半衰期延长,餐后2h胰岛素可为基础值的8~12倍,血胰岛素/C肽比值升高。因C肽很少被肝脏代谢,主要以原形从肾脏排泄,此时血、尿C肽测定可更精确反映内源性胰岛素的分泌。
肝源性
糖尿病的治疗一方面注意改善肝功能,避免应用损害肝功能的药物;另一方面注意在总热量不变时宜少食多餐,必要时配合应用α-葡萄糖苷酶抑制剂(从小剂量开始,同时注意检测肝功能)或餐前皮下注射小剂量的短效胰岛素,一般不应用磺酰脲类药物或双胍类口服降血糖药物,噻唑烷二酮衍生物不建议使用。一些纯中药制剂也可考虑使用。
3.胰源性
糖尿病 许多胰腺疾病如急性坏死性胰腺炎、胰腺肿瘤术后及原发性和继发性血色病(多由长期多次输血致过多的铁质沉积于脏器,包括胰腺,致其纤维化和退行性变等),可导致胰岛素分泌的相对或绝对缺乏,出现
糖尿病,大多需要外源性胰岛素替代治疗。但由于同时有胰岛A细胞量的减少,故胰岛素的需要量相对少。
4.内分泌疾病
(1)
甲状腺功能亢进症(
甲亢):
甲亢患者糖代谢异常的发生率明显增加。
甲亢时甲状腺素分泌增加,促进肝脏和外周组织对葡萄糖的利用,同时加速糖原的分解和异生,加速肠道对葡萄糖的吸收,使血糖升高;甲状腺素通过cAMP激活肾上腺素能β受体,增强儿茶酚胺活性,使儿茶酚胺增多,抑制胰岛素释放,并使胰升糖素受到刺激,血糖升高。
甲亢本身所致的糖耐量减低或
糖尿病,FPG一般增高不明显,且随着
甲亢的控制,糖代谢紊乱常随之恢复。若
甲亢合并持续性空腹高血糖,重度糖代谢紊乱,甚至发生
糖尿病急性并发症者;或
甲亢症状控制,高血糖仍持续存在者,则可诊断
甲亢合并
糖尿病。若胰岛B细胞功能显著低下或胰岛细胞自身抗体如ICA及GAD-Ab阳性等,则可考虑为
甲亢合并1型
糖尿病;若胰岛素相对缺乏,酮症抵抗,体内自身抗体阴性,可考虑
甲亢合并2型
糖尿病。另外,
甲亢可使原先存在的
糖尿病病情加重。
甲亢合并
糖尿病需两者兼治。合并1型
糖尿病则需应用胰岛素治疗,合并2型
糖尿病在抗
甲亢治疗的同时,可采取口服降血糖药物或胰岛素治疗。
(2)生长激素瘤:儿童起病引致
巨人症,成人起病引致
肢端肥大症。长期高水平的生长激素有拮抗胰岛素调节糖代谢的作用,可引起垂体性
糖尿病或糖耐量减低。
糖尿病多在
肢端肥大症之后出现,一些患者也可表现为早期或同时发现。有报告
肢端肥大症者
糖尿病和糖耐量减低的发生率为24.3%和27.1%,典型的临床表现有助于鉴别。生长激素瘤合并
糖尿病常需胰岛素治疗,且一般剂量较大。针对垂体生长激素瘤体的治疗(手术或放疗)或瘤体的卒中可使
糖尿病减轻或消失。
(3)皮质醇增多症(Cushingss syndrome):皮质醇可促进肝糖原异生并拮抗胰岛素对糖代谢的作用,致糖耐量异常,大部分为I
GT,约20%表现为
糖尿病即类固醇性
糖尿病,病情一般较轻。针对病因如垂体促肾上腺皮质激素瘤、肾上腺瘤、肾上腺增生癌或异位促肾上腺皮质激素综合征等的治疗可减轻糖代谢的异常,甚至使糖代谢恢复正常。亦可见于长期使用糖皮质激素的病例。
(4)嗜铬细胞瘤:肾上腺素和去甲肾上腺素分泌过多可使肝糖原和肌糖原分解增加,促进肝脏糖原异生,拮抗胰岛素的外周作用;高儿茶酚胺血症,能兴奋胰岛α受体(致胰升糖素分泌增加),并抑制胰岛素分泌,从而导致血糖升高。文献报告,嗜铬细胞瘤80%合并糖代谢紊乱,
糖尿病的发生率为10%~24%,肿瘤切除后,糖代谢紊乱可恢复正常。另外,患有嗜铬细胞瘤的患者,因存在高儿茶酚胺血症,脂肪分解加速,酮体产生增加,当氧化不全时,有时临床以
糖尿病酮症甚至酮症酸中毒为首发表现,而延误嗜铬细胞瘤的诊断。
(5)胰岛A细胞瘤:瘤体分泌过多的胰升糖素,促进肝糖原和肌糖原分解,同时拮抗胰岛素的外周作用,使血糖升高。文献报告本病50%伴有
糖尿病,所致
糖尿病一般为轻至中度,酮症不易感。其他主要临床表现有:①坏死性溶解性游走性红斑,反复发生以下肢、臀部、股部和会阴部为主的红斑→水疱→破溃→结痂→脱屑伴色素沉着,邻近部位可融合,向周围扩散时,中心病变部位可融合,常伴有奇痒,该表现为本病的特征性病变;②口炎,呈红牛肉样舌炎及指甲分离;③
腹痛,15%有
腹泻;④正细胞正色素性贫血伴血沉增快;⑤食欲良好,但体重下降;⑥低氨基酸血症,血胆固醇降低;⑦O
GTT时,血胰升糖素反而升高。确诊有赖于胰升糖素的测定[多大于143.5pmol/L(500pg/ml)]和影像学如CT、MRI和B超等定位检查(肿瘤直径3~35cm,以胰尾部多见,约70%为恶性,50%伴肝转移)。
(6)生长抑素瘤:为胰腺分泌生长抑素的D细胞瘤,通过抑制胰岛素分泌亦可致
糖尿病。
糖尿病轻重不一,可伴有
糖尿病酮症酸中毒。由于过高的生长抑素同时还抑制其他胃肠内分泌激素(如胰升糖素、胃泌素、胆囊收缩素、肠抑胃素和生长激素等)的分泌,导致胃酸和胰外分泌减少,胆囊及小肠功能紊乱,肠钙和脂肪吸收减少,临床除
糖尿病表现外,常有贫血、胃酸分泌减少、胆囊病、消化不良、
腹泻(脂肪泻)和体重减轻等。确诊有赖于生长抑素的测定(高达正常人水平的100倍)和影像学检查(体积多较大,半数位于胰头部位,50%为恶性,伴局部淋巴结或肝转移)。
5.药物和化学物质 某些药物或化学物质可影响葡萄糖耐量。故在做O
GTT试验前应停药3~7天,甚至1个月以上。
6.非
糖尿病性糖尿 一般情况良好,常无症状。尿糖的出现不伴有血糖的增高,糖耐量试验在正常范围。其病因较多,常见的有慢性肾衰、妊娠(多在第3~4个月)、各种继发性近曲小管病变(如锂中毒)和遗传性肾小管病变如Fanconi综合征等,鉴别诊断比较容易,同时检测血糖和尿糖,若血糖在正常范围,而尿糖阳性则
肾性糖尿成立,一般无特殊处理。
 治疗
治疗
治疗:
1.老年糖尿病的治疗目标
(1)控制高血糖,但要严防低血糖,使其血糖水平略高于青壮年,理由是:①老年人较青壮年更易于发生低血糖,且往往又缺乏自觉症状,以致产生重度低血糖甚至昏迷;②老年人多伴有动脉硬化,即使1次低血糖发作,便可能诱发脑血管意外或心肌梗死;③老年人易饮食摄入量不规律,进食多则高血糖,少则低血糖;④老年人多肾功能减退,导致降糖药物排泄缓慢,造成在体内蓄积产生迟发性低血糖。
(2)防止营养过度或缺乏,使机体摄取生理需要的营养。
(3)防止体重过重或过轻,保持不胖不瘦状态。
(4)避免过度体力活动或缺乏活动,要运动适中。总之要履行综合性的饮食控制、运动、药物及自我管理等措施,维持机体较佳状态。
在为老年糖尿病患者制定安全而合理的长期治疗计划时必须考虑老年糖尿病的诸多特点:①患者的预期寿命;②有否并发症及其程度;③有否并存症及其程度;④有否神经精神障碍及其程度;⑤患者实施糖尿病治疗计划的依从性及能力;⑥家庭条件与社会保健的承受情况等。
2.老年糖尿病糖代谢控制参考标准 对此各学者意见不一,但略高于青壮年水平是一致的,所不同者为具体指数。本篇综合多数学者的看法及笔者个人体会,提出如下参考标准(表6)。但必须指出,当参照该标准时还要考虑到患者的家庭、社会心理等因素,应因人而异、因病而异、因条件而异。
3.治疗方法
(1)基本疗法:
①饮食控制疗法:适应证:任何类型的糖尿病均应终生进行饮食控制;凡是新发现的2型糖尿病空腹血糖在11.1mmol/L(200mg/dl)以下者,首先应进行单纯饮食控制及适当运动,经控制1个月后达到上述标准者继续饮食控制并定期检查;未达到标准者再加用口服降糖药治疗。饮食控制首先强调对每天总热量的限制,按每千克标准体重[身高(cm)-105=kg]25kcal计算。热量分配原则及比例为高糖类占60%~70%,每天约200~300g(单糖如
葡萄糖、蔗糖等忌用);适量蛋白质占15%,0.8~1.Og/(kg·d);低脂肪占20%~25%,约0.5~0.8g/(kg·d),胆固醇不超过250mg/d。食品种类应注意选择。可溶性高纤维素食品有利于改善糖、胆固醇和低密度脂蛋白的代谢,有利于通便、缓解便秘,可相应的减少药物用量,老年患者至少每天摄入30g。含纤维素食品甚多,如豆类、块根类、绿色蔬菜、粗制谷物类及水果等。水果既含纤维素也含有一定的糖分,故可吃但不可多吃,最好按食品换算法相应地减少主食量,如西瓜0.5kg,葡萄0.25kg,鸭梨0.23kg,桃或广柑或柿子0.18kg,橘子或苹果0.15kg等减少主食半两(13g)。市场销售的麦麸、苦荞麦、南瓜等所制成的代食品可推荐食用。
②运动疗法:对老人尤为重要,因随年龄增长运动量相应减少,又多失去工作劳动机会,故应为老年糖尿病患者制定恰如其分的运动处方。运动有利于改善糖耐量,减少药物用量,增强全身适应能力和健康的自我感觉,增加热卡消耗降低体重和血脂。在制定运动处方前应进行心、肺、肝、肾等功能检查。运动的强度及种类要依病情、并发症、并存症、体力及运动史等而定。可采用散步、慢跑步、体操、跳舞、太极拳及短程骑自行车等形式。强度要适中,以不出现心脏症状、心率不超过每分钟170减去年龄为限度。
③自我管理:进行糖尿病知识教育,增强患者自我保健技能,争取自己管理自己对老年糖尿病同样重要。其中采用简易快速血糖测定仪自测或由家属协助测定对老年人尤为重要,因老年患者多行动不便,血糖自我监测将会给老年患者减少许多麻烦并有利于提高疗效。一些发达国家已广为普及。我国在目前尚难以普及的情况下,各医疗部门特别是设有糖尿病专科者应推广使用。北京医院中西医结合糖尿病研治中心建立了仅采2滴指血(1滴测空腹血糖及GHb,1滴测餐后2h血糖)做到半天检测与就诊,不仅方便于老年患者且明显提高了疗效。
(2)药物疗法:
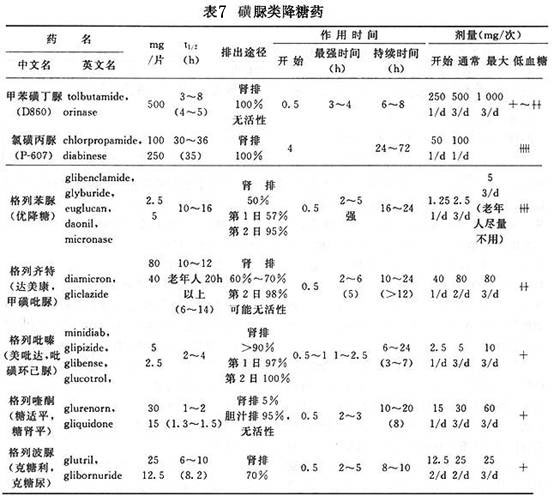
①磺脲类降糖药疗法:
A.老年糖尿病选择磺脲类药种类的原则:宜选用半衰期短、排泄快、在机体内潴留时间短的短、中效药物;在肝脏内酵解后所产生的代谢产物基本失去活性者;对肝、肾尽可能无毒害者。
B.降血糖机制:刺激胰岛B细胞分泌胰岛素;增强靶细胞上胰岛素受体的敏感性;阻止肝糖输出。
C.适应证:非肥胖2型糖尿病经基本疗法后仍不能达标者;新发现的2型糖尿病空腹血糖>11.1mmo1/L者;经胰岛素及C肽释放试验证实B细胞尚有较好储备功能但又不是高胰岛素血症者;糖尿病肾病注射胰岛素困难者可试用
格列喹酮(
糖适平)。
应强调指出,对饮食不规律或神经精神障碍者,应在每次饭后服药而不要在饭前15~30min,以免服药与进餐的间隔时间过长或根本忘记进餐导致低血糖反应。
D.药物种类及用法(表7):
②双胍类降糖药疗法:
A.降血糖机制:抑制食欲及肠壁对
葡萄糖的吸收;不刺激B细胞分泌胰岛素,故不会引起或加重高胰岛素血症;抑制肝糖输出;增加靶细胞中胰岛素受体数目及其对胰岛素的亲和力,增强其敏感性;增加肌肉细胞对
葡萄糖的无氧酵解;有一定的降血脂作用,减轻体重;不会引起低血糖反应。
B.适应证:较肥胖的2型糖尿病患者经饮食控制及运动疗法仍不能达标,且实验证明B细胞储备功能良好者可首选双胍类,单用磺脲类药产生原发或继发失效者;对磺脲类药过敏者;高血糖兼高胰岛素血症者。
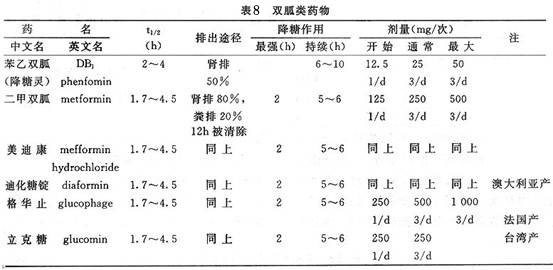
C.种类与用法:常用的为
二甲双胍,因其产地不同,名称各异,见表8。
D.合理应用:服用
二甲双胍开始剂量宜小,125~250mg/次,1~2次/d,进餐时服。约1周后,如血糖控制不佳,可增至250mg/次,2~3次/d,总剂量<1500mg/d。根据血糖水平逐渐调整剂量,通常需要2~3周的治疗才达降糖疗效。如果血糖已控制,可适当减少剂量。特别是老年2型糖尿病,应定期检查血象、肝功、血尿素氮和肌酐、肌酐清除率。服药期间不饮酒,因乙醇可抑制肝糖异生,增强
二甲双胍的降糖作用。用药期间注意其他合并症的用药。注意药物之间的相互作用,如西咪替丁可降低
二甲双胍的肾脏排泄,增强
二甲双胍的生物利用度,使血
二甲双胍浓度升高,乳酸/丙酮酸比值升高,应将
二甲双胍剂量减少。
老年人糖尿病患者有高血糖、高胰岛素血症,血三酰甘油和载脂蛋白B水平升高,HDL-C水平降低者,无明显肝、肾、心、肺功能不全者,
二甲双胍类药物的应用最为合适。
二甲双胍也可用于X综合征,降低胰岛素抵抗,延缓心血管病的发生,减轻肥胖症。
A.降糖机制:
阿卡波糖在小肠吸收极少,能竞争性抑制
葡萄糖淀粉酶、蔗糖酶和
麦芽糖酶,从而使淀粉、蔗糖、
麦芽糖和糖类分解及吸收明显减少,因此,
阿卡波糖能降低老年糖尿病患者的餐后血糖及尿糖,对脂肪生成和脂肪酸代谢有一定影响,可降低体脂及血三酰甘油水平,有利于防止动脉粥样硬化、冠心病及视网膜病变的发生;不易产生低血糖。
B.适应证:经单用磺脲类或双胍类药仍不能达标的老年2型DM可试用
阿卡波糖1个月,如仍无效改用其他疗法:可配合磺脲类或胰岛素治疗空腹及餐后血糖明显升高的2型DM;
阿卡波糖与胰岛素治疗的患者,可减少胰岛素用量和稳定血糖。
C.副作用:主要为消化道反应,如腹胀、肠鸣、排气、食欲减退等。
④中药疗法:中国是发现并治疗糖尿病(古称消渴病)的最早国家之一。古代各医者曾提出近百种医治消渴病的中药,比较集中提到的药物有
人参、玄参、地黄、瓜蒌、泽泻、麦门冬、黄连等。
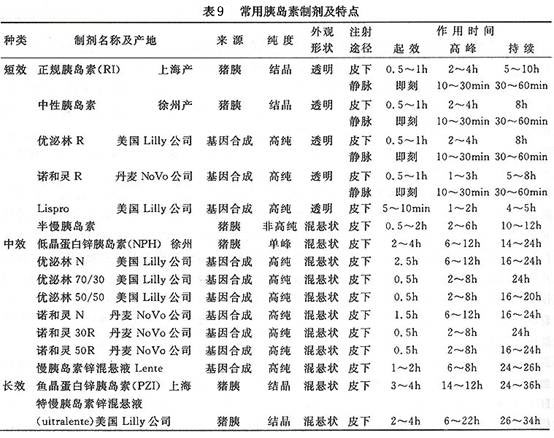
⑤传统胰岛素疗法:
A.适应证:青壮年1型糖尿病延续至老年期者;经磺脲类加胰岛素联合治疗仍不能达标者;磺脲类与双胍类药联合疗法无效且B细胞储备功能较差者;单纯酮症(酮体阳性)、外伤、重症感染、较大手术及其他应激情况,一般多用短期静滴或强化疗法;糖尿病酮症酸中毒、乳酸性酸中毒、糖尿病非酮性高渗综合征、糖尿病眼、肾、足等合并症及严重的心、肝、脑等并存症。这些患者依病情可能长期或短期注射胰岛素。有些患者还可能胰岛素与口服降糖药交替使用。
B.种类与用法:胰岛素的种类(表9),用法基本与青壮年相同,详见成人部分。但剂量要比成人少1/3~1/5,最好用短效(
普通胰岛素)或中效(NPH)胰岛素为宜。
(3)磺脲类药物继发性失效:磺脲类药物可发生失效,按失效发生的早晚,可分为原发性失效和继发性失效(SFS)两类。老年糖尿病绝大多数属后者。
糖尿病患者服用磺脲类药物治疗初期能有效地控制血糖,但长期服用后疗效逐渐下降,血糖不能控制,甚至无效。判定标准是:每天应用最大剂量(如格列苯脲15mg/d,疗程3个月)空腹血糖仍>10mmol/L,HbA1>9.5%,称为SFS。SFS的发生率为20%~30%,年增长率为5%~10%。
①发生SFS的因素:通常SFS的发生与胰岛B细胞功能下降和外周组织的胰岛素抵抗性密切相关。其他因素尚有:饮食控制不严格,活动量过少;磺脲类药剂量不够,吸收障碍;同时服用了升高血糖的制剂如糖皮质激素等;患者产生应激反应;心理因素等。
②SFS的处理:
A.加用胰岛素治疗:不停用磺脲类药物,而加用适量的胰岛素。胰岛素可降低高血糖症和降低外周组织对胰岛素的抵抗性。更有利于胰岛B细胞对磺脲类药的反应,改善B细胞膜磺脲类受体与磺脲类的亲和力,增强B细胞分泌胰岛素的功能。加用胰岛素的方法有3种:应用磺脲类药物如
格列喹酮60mg/次,3次/d,晚9时加用
中效胰岛素(NPH)10~20U;早、晚餐前加用NPH;三餐前加用
正规胰岛素(
RI)。
C.加用胰岛素和
二甲双胍:磺脲类药剂量不变,加服
二甲双胍0.25~0.5g/次,3次/d;并在睡前用NPH0.1~0.2U/kg。
F.肥胖型患者加用
芬氟拉明20mg/次,3次/d,口服,并减少热量摄入至1000kcal/d左右,据报道体重指数降低6%~8%时,可逆转SFS。也可加用血管紧张素转换酶抑制剂(ACEI)如卡托普利、伊那普利,具有胰岛素增敏剂的作用。
G.改用胰岛素治疗:首先行胰高血糖素刺激C肽释放试验,如C肽值仍<0.6ng/L,提示胰岛B细胞功能差,应改用胰岛素治疗。



 流行病学
流行病学


 病因
病因
 发病机制
发病机制
 临床表现
临床表现

 并发症
并发症
 实验室检查
实验室检查
 其他辅助检查
其他辅助检查
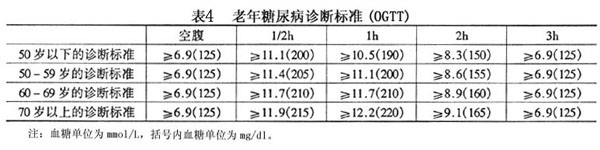
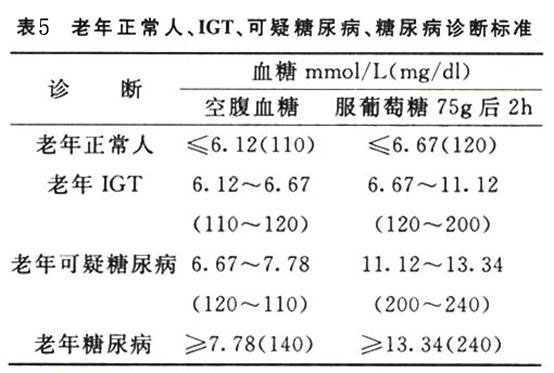
 诊断
诊断
 鉴别诊断
鉴别诊断
 治疗
治疗

 预后
预后
 预防
预防